近期,美高梅集团医学院李诚予团队在荧光生物传感器研究领域取得新进展,相关研究成果发表于《Analytical Chemistry》(3篇,自然指数期刊)、《Chemical Engineering Journal》、《Sensors and Actuators B: Chemical》等TOP期刊上。
(1)为进一步提升CRISPR/Cas12a荧光生物传感器在复杂样本中的工作能力,李诚予团队将基于长余辉发光共振能量转移的检测模式引入其中,并结合功能化DNA的调控方式以及光子晶体生物芯片的信号放大策略(图1),分别实现了人血浆中癌胚抗原和Na+的高灵敏分析。研究成果“Biomimetic Chip Enhanced Time-Gated Luminescent CRISPR-Cas12aBiosensors under Functional DNA Regulation”发表于分析化学学科TOP期刊《Analytical Chemistry》上。李诚予为该论文的第一作者兼通讯作者,西湖大学博士后郑贝,美高梅集团医学院卢莉莉教授为共同第一作者。
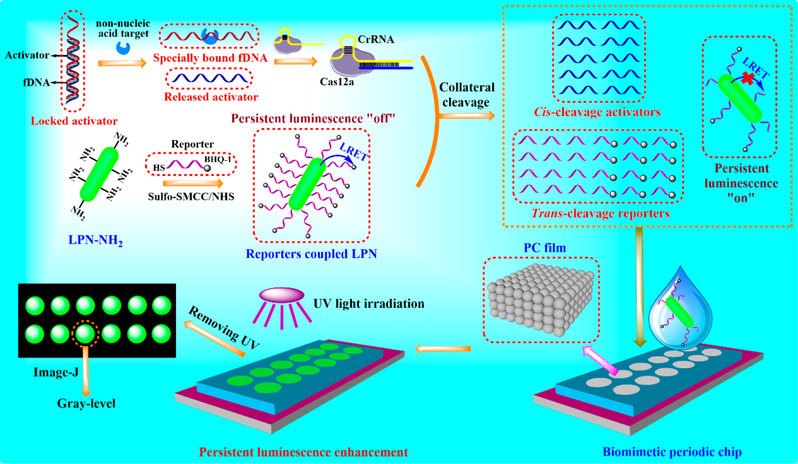
图1. 基于长余辉发光共振能量转移检测模式的CRISPR/Cas12a荧光生物传感器
(2)为进一步提升CRISPR/Cas12a荧光生物传感器的检测灵敏度,李诚予团队通过结合DNA walker信号放大器,构建了一种“一对多”型CRISPR/Cas12a荧光生物传感器,并采用链置换和适配体竞争原理,分别实现了人血浆中microRNA-122和癌胚抗原的超灵敏分析。研究成果“An exceptional and universal DNA walker amplified “one-to-many” CRISPR/Cas12a-mediated fluorescent biosensor for ultrasensitive detection of non-DNA biomarkers”发表于传感器领域TOP期刊《Sensors and Actuators B:Chemical》上。李诚予为该论文的第一作者兼通讯作者。
(3)为进一步拓展CRISPR/Cas12a荧光生物传感器的实际应用,李诚予团队将其应用于病毒性心肌炎动物模型的检测。研究成果“Monitoring of viral myocarditis injury using an energy-confined upconversion nanoparticle and nature-inspired biochip combined CRISPR/Cas12a-powered biosensor”发表于分析化学学科专业期刊《Analytica Chimica Acta》上。美高梅集团医学院卢莉莉教授为该论文的第一作者,李诚予为通讯作者。
(4)针对熵驱动DNA放大器的启动不可控以及易于被生物体内核酸酶降解等缺点,李诚予团队将光控传感技术引入其中,并将熵驱动的探针核酸嫁接于DNA四面体上,通过选择金属共价有机框架材料作为传递载体,有效实现了活细胞内microRNA的成像分析(图2)。研究成果“A Photoresponsive and Metal-Organic Framework Encapsulated DNA Tetrahedral Entropy-Driven Amplifier for High-Performance Imaging Intracellular MicroRNA” 发表于分析化学学科TOP期刊《Analytical Chemistry》上。美高梅集团医学院硕士研究生高佳灵和刘宇恒为该论文的共同第一作者,李诚予为通讯作者。进一步的,李诚予团队选择MnO2纳米薄膜作为传递载体,构建了一种谷胱甘肽响应型的光控熵驱动DNA放大器,并将其引用于活体内microRNA的成像分析。研究成果“A dual DNA tetrahedrons and MnO2 nanosheets sustained entropy-driven DNA amplifier enables high-performance operation in live cells and bodies under a light-gated manner”发表于工程技术领域TOP期刊《Chemical Engineering Journal》上。美高梅集团医学院硕士研究生刘宇恒、刘俊贤和高佳灵为该论文的共同第一作者,李诚予为通讯作者。
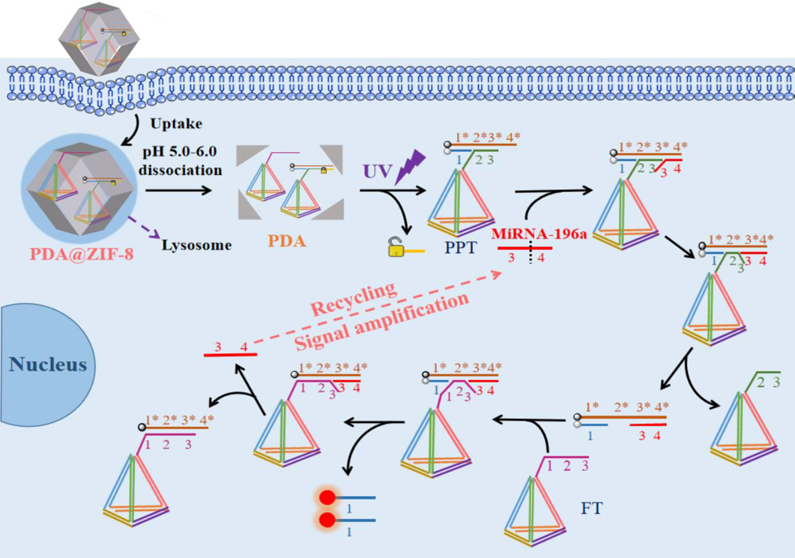
图2. 基于光控传感技术和DNA四面体构建的熵驱动DNA放大器
(4)针对DNA motor的启动不可控以及需要额外补充驱动力等缺点,李诚予团队将基于上转换发光的光控传感技术引入其中,并选择MnO2纳米薄膜作为驱动力提供源,有效实现了活细胞和活体内messenger RNA的成像分析(图3)。研究成果“Upconversion Luminescence-Initiated and GSH-Responsive SelfDriven DNA Motor for Automatic Operation in Living Cells and InVivo”发表于分析化学学科TOP期刊《Analytical Chemistry》上。李诚予为该论文的第一作者兼通讯作者。
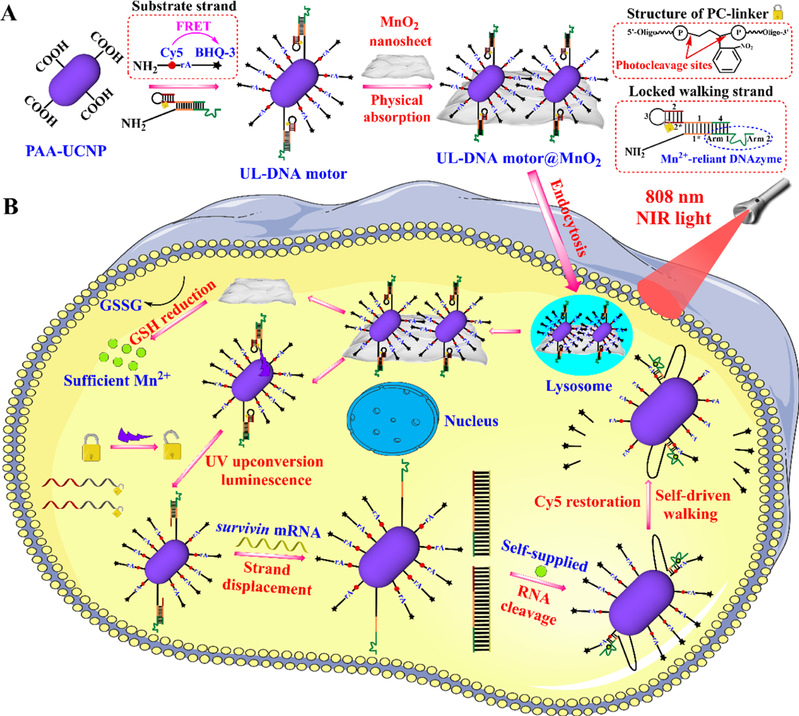
图3. 基于上转换发光的光控传感技术和MnO2纳米薄膜构建的DNA motor
以上研究工作得到国家自然科学基金、湖北省省级人才计划以及美高梅mgm集团2288国家“优青“培育计划的资助。(医学院)
论文链接:
《Analytical Chemistry》(1)
https://pubs.acs.org/doi/abs/10.1021/acs.analchem.1c01403
《Analytical Chemistry》(2)
https://pubs.acs.org/doi/10.1021/acs.analchem.1c04105
《Analytical Chemistry》(3)
https://pubs.acs.org/doi/abs/10.1021/acs.analchem.2c00830
《Chemical Engineering Journal》
https://www.sciencedirect.com/science/article/pii/S1385894722010920
《Sensors and Actuators B:Chemical》
https://www.sciencedirect.com/science/article/pii/S0925400522003859
《Analytica Chimica Acta》
https://www.sciencedirect.com/science/article/pii/S0003267022000265
