武科大网讯 11月22日,美高梅集团生命科学与健康学院祝海川副教授、北京大学第三医院林坚研究员和军事医学研究院钟武研究员作为共同通讯作者,在国际肿瘤和血液肿瘤权威期刊J Hematol Oncol(IF 28.5, 中科院一区Top期刊) 发表了题为:Direct inhibition of dioxygenases TET1 by the rheumatoid arthritis drug auranofin selectively induces cancer cell death in T-ALL的研究论文。北京大学第三医院陈龙副研究员、美高梅集团研究生任安琪、赵院为论文的共同第一作者,美高梅集团张同存教授和北京大学生命科学学院伊成器教授为本论文提供了技术支持。
表观遗传调控在血液肿瘤中发挥着重要作用,尤其是DNA甲基化异常调控对血液肿瘤的发生、发展都有着显著影响。T细胞急性淋巴细胞白血病(T-ALL)是一种恶性的血液肿瘤,现有药物治疗预后差,且易复发。前期的研究显示DNA表观遗传与T-ALL的发生和发展存在相关性,但具体的机制和靶向治疗药物仍然有待揭示。
本项研究针对高复发和预后差的T-ALL展开,首先发现 DNA去甲基化酶TET1在临床T-ALL病人样本中显著高表达,且与患者预后呈现负相关。细胞和动物水平实验表明,特异性的降低TET1,可以有效的抑制T-ALL的生长与进展,从而预示T-ALL细胞的死亡与TET1调控的DNA表观遗传的改变紧密相关,而TET1的高效特异性抑制剂有可能是T-ALL的有效治疗策略。
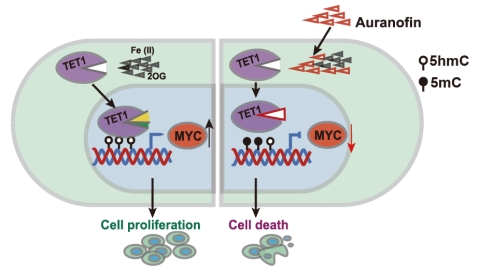
针对目前临床上TET1高效抑制剂缺乏的现状,研究团队利用结构引导虚拟筛选和细胞水平高通量药物筛选的策略,在超过2000个的FDA批准的上市药物库中,发现已批准上市的治疗类风湿性关节炎的药物-金诺芬(Auranofin)可以高效、特异性的抑制TET1蛋白酶活及下游功能。进一步研究发现,Auranofin通过与底物竞争性结合底物结合“口袋”,从而抑制TET1的催化活性。全基因组水平的DNA表观遗传(5-甲基胞嘧啶和5-强甲基胞嘧啶)测序进一步证实TET1的高效抑制导致多种基因启动子区DNA去甲基化过程的下调(5mC水平上调,5hmC水平下调),暗示TET1抑制剂可能通过甲基化抑制特定基因的表达从而调控T-ALL细胞的增殖;基于此设想,团队进一步证明TET1抑制通过表观遗传调控了原癌基因c-Myc表达的下调,从而介导了T-ALL的死亡。
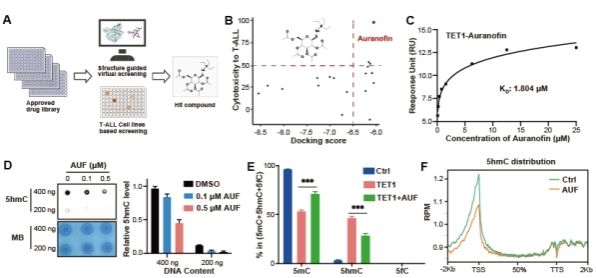
本研究进一步揭示了TET1是T-ALL的潜在治疗靶点,并首次发现了治疗类似风湿的药物Auranofin是TET1的高效特异性抑制剂,可以作为T-ALL的潜在治疗药物,目前该药物应用于T-ALL的治疗正在积极推进临床有效性的研究,将来有望真正应用于T-ALL的临床治疗。同时本研究揭示了TET1通过DNA表观遗传和c-Myc信号通路调控T-ALL的机制,为更多T-ALL治疗药物的发展提供了机制支撑。(生科院)
原文链接:https://jhoonline.biomedcentral.com/articles/10.1186/s13045-023-01513-6
